Autores: Marta García Torres. MIR R1. Daniel Planchuelo Calatayud, metge de família i tutor EAP Dreta de l’Eixample (CAP Roger de Flor)
Introducció
L’aparició d’un nou coronavirus el desembre del 2019, la síndrome respiratòria aguda severa coronavirus 2 (SARS-CoV-2), ha tingut conseqüències devastadores a nivell mundial. L’Organització Mundial de la Salut va declarar la pandèmia de Covid-19 el dia 11 de març del 2020, i des de llavors fins a la redacció d’aquest article s’han produït més de 123.000.000 de casos d’infecció i més de 2.700.000 morts a tot el món. Des del seu inici s’han dut a terme moltes mesures per frenar-la, com ara confinaments totals o parcials, l’ús de mascaretes, el distanciament físic, l’aïllament d’infectats i contactes, proves de cribratge massiu, … que han ajudat a limitar la transmissió. Tot i això, malgrat l’aplicació d’aquestes mesures, continuem observant taxes elevades d’afectats per Covid-19, fet que ha fet necessari el desenvolupament de vacunes per tractar de reduir la morbiditat, mortalitat i la seva transmissió, i aconseguir així contenir la pandèmia.
En aquest article realitzarem una anàlisi de les diferents vacunes contra la Covid-19, amb especial interès, en les aprovades per comercialitzar-les a la Unió Europea fins a la data de la redacció d’aquest article.
Característiques del SARS-CoV-2
El SARS-CoV-2 pertany a la subfamília Orthocoronavirinae dins de la família Coronaviridae. Estructuralment els coronavirus són virus esfèrics de 100-160 nm de diàmetre, amb embolicada de bicapa lipídica i contenen ARN monocatenari no segmentat (ssRNA). El genoma del virus SARS-CoV-2 codifica 4 proteïnes estructurals: la proteïna S (spike protein), la proteïna E (envelope), la proteïna M (membrane) i la proteïna N (nucleocapsid). La proteïna S es troba a la membrana del SARS-CoV-2, la seva funció principal és mediar l’entrada a la cèl·lula allotjadora. La proteïna S posseeix dues subunitats (S1 i S2); La subunitat S1 és la que interacciona i s’uneix al receptor ACE2 (enzim convertidor d’angiotensina 2) per mitjà del domini d’unió al receptor (RBD), mentre que la subunitat S2 determina la fusió de la membrana del virus amb la de la cèl·lula hoste, iniciant així la cascada de replicació viral. (1)
El paper destacat de la proteïna S a la replicació viral del SARS-CoV-2, ha fet que es converteixi en una molècula clau per al desenvolupament de vacunes.
Font: Departament de Salut
Tipus de vacunes contra el SARS-CoV2 (1) (2) (3)
- Vacunes de subunitats proteiques: Estan constituïdes per components proteics aïllats del SARS-CoV-2. La majoria s’associen a un adjuvant que aconsegueix augmentar la vida mitjana de la vacuna millorant-ne la capacitat immunògena. La proteïna aïllada pot ser:
-
- Proteïna S completa: Indueix una forta immunogenicitat, és l’antigen més prometedor per al desenvolupament de la vacuna COVID-19.
- Basada en la RBD: produeixen reaccions immunològiques duradores i segures, són més immunògenes que les basades en la proteïna S completa. Tenen l’avantatge que el domini RBD és igual al SARS-CoV-1 i al SARS-CoV-2 per la qual cosa el converteix en un objectiu prometedor per al desenvolupament de vacunes amb un doble objectiu.
- Basades a la subunitat S2: La seva potència és menor que els basats en RBD. Com que la subunitat S2 és la implicada en el procés de fusió cel·lular, té un potencial prometedor per desenvolupar una vacuna contra soques de virus divergents.
- Vacunes de vectors virals: Es basen en virus modificats genèticament, diferents del SARS-CoV-2, que transporten al seu interior informació genètica del SARS-CoV-2 per sintetitzar la proteïna S. Aquests vectors poden ser replicants o no replicants.
- Vacunes de virus atenuats: Mitjançant la modificació genètica s’eliminen els gens de virulència del SARS-CoV-2 de manera que s’obté una versió atenuada del virus que en conserva la capacitat immunògena.
- Vacunes de virus inactivats: Els virus continguts en aquestes vacunes estan completament inactivats de manera que conserven la immunogenicitat, però no poden produir la infecció. La immunogenicitat és menor que a les vacunes vives, per la qual cosa es necessiten més dosis de reforç. Es tracta de vacunes segures, especialment per a persones immunodeprimides.
- Vacunes d’ARN missatger (ARNm): La vacuna conté material genètic en forma d’ARNm del SARS-CoV2 que codifica la proteïna viral S, vehiculada en nanopartícules lipídiques. Quan s’injecta, l’ARNm és captat per les cèl·lules de l’hoste, s’expressa la proteïna S i es mostra a la superfície cel·lular desencadenant la resposta immune.
- Vacunes d’ADN: La vacuna conté material genètic amb forma d’ADN. Les vacunes d’ADN que es dirigeixen a les proteïnes S, M i N, actualment està en estudi la seva eficàcia i immunogenicitat en persones.
Vacunes autoritzades per la Unió Europea:
Procés d’autorització de les vacunes (4)
Per poder introduir una vacuna nova al mercat de la Unió Europea, primer s’ha de sol·licitar el permís a l’Agència Europea del Medicament (sigles en anglès E.M.A.) que s’encarrega d’avaluar la seva qualitat, eficàcia i seguretat, una vegada aquesta emet la seva recomanació, es trasllada la decisió a la Unió Europea, que és qui finalment accedeix a donar el permís de comercialització.
L’E.M.A. fa un examen independent, exhaustiu i consistent de totes les proves que aporta el laboratori que desenvolupa la vacuna. En aquest procés s’efectuen diverses comprovacions i se sospiten diversos factors sobre la base d’un sistema de revisions per especialistes, intervenint-hi dos responsables de l’avaluació, un revisor científic, comitès especialitzats i grups de treball com el Comitè per a l’Avaluació de Riscos en Farmacovigilància o el Grup de Treball sobre Biologia. Finalment, el Comitè de Medicaments d’ús Humà de l’E.M.A. és qui emet la recomanació final, aquesta recomanació serà favorable sempre que les proves demostrin que els beneficis de la vacunació són més grans que qualsevol risc derivat de la vacuna.
Vacunes d’ARNm:
Vacuna de Pfizer / BioNTech (BNT162b2) (5)
Autorització per l’Agència Europea del Medicament (E.M.A): El 21 de desembre del 2020. Primera vacuna comercialitzada.
Com s’administra: La pauta d’administració és intramuscular de dues dosis de 0,3 ml (30 micrograms d’aquest ARNm) administrades per via intramuscular en un interval de 21 dies.
Indicacions: Indicada en persones de 16 anys o més.
Contraindicacions: Contraindicada en cas d’hipersensibilitat al principi actiu o a algun dels excipients inclosos.
Eficàcia: L’eficàcia és del 95% després de 7 dies des de l’administració de la segona dosi. Es va avaluar l’eficàcia de la vacuna BNT162b2 contra la COVID-19 respecte del placebo en persones de 16 anys o més. Es van administrar dues dosis amb 21 dies de diferència, i es va objectivar una eficàcia de la vacuna BNT162b2 del 95% en la prevenció de la Covid-19 (interval creïble del 95%, 90,3 a 97,6). Entre la primera i la segona dosi, es va objectivar una eficàcia de la vacuna del 52% (IC del 95%, 29,5-68,4) durant aquest interval el que indica una protecció primerenca per part de la vacuna, començant tan aviat com 12 dies després de la primera dosi.
Seguretat: Es tracta d’una vacuna amb un perfil de seguretat acceptable semblant a altres vacunes virals.
Reaccions adverses: Les reaccions adverses més freqüents van ser dolor al lloc d’injecció (>80 %), fatiga (>60 %), cefalea (>50 %), miàlgia i calfreds (>30 %), artràlgia (>20 %) i febre i inflor al lloc d’injecció (>10 %), i generalment van ser d’intensitat lleu o moderada i es van resoldre en un termini de pocs dies després de la vacunació. Una edat més gran es va associar a una freqüència lleugerament menor d’esdeveniments de reactogenicitat. Els efectes secundaris sistèmics van ser més comuns després de rebre la segona dosi de la vacuna.
Vacuna de Moderna / Lonza (ARNm-1273) (6)
Autorització per l’E.M.A: El 6 de gener del 2021. Segona vacuna comercialitzada.
Com s’administra: La pauta d’administració és de dosis de 0,5 ml (100 micrograms d’aquest ARNm) administrades per via intramuscular amb un interval de 28 dies.
Indicacions: Indicada en persones de 18 anys o més.
Contraindicacions: Contraindicada en cas d’hipersensibilitat al principi actiu o a algun dels excipients inclosos.
Eficàcia: L’eficàcia de la vacuna és del 94,1% després de 14 dies de l’administració de la segona dosi. Es va avaluar l’eficàcia de la vacuna ARNm-1273 contra la COVID-19 respecte al placebo en persones de 18 anys o més. Es van administrar dues dosis amb 28 dies de diferència, i es va objectivar una eficàcia de la vacuna ARNm-1273 del 94,1% en la prevenció de la Covid-19, incloent-hi la malaltia greu per SARS-CoV-2. Desglossant els grups analitzats a l’estudi es va observar que en el grup de majors de 65 anys l’eficàcia és del 86,4% (IC 95%: 61,4%-95,2%) i en el de 18-65 anys del 95,6%, (IC95%: 90,6%-97,9%).
Seguretat: No es van identificar problemes amb la seguretat de la vacuna.
Reaccions adverses: Les reaccions adverses notificades amb més freqüència seran dolor al lloc de la injecció (92%), fatiga o sensació de cansament (70%), cefalea (65%), miàlgies (61%), calfreds (45 %), artràlgies (46%), nàusees i vòmits (23%), febre (15%), inflor al lloc d’injecció (15%) i envermelliment (10%). Generalment van ser d’intensitat lleu o moderada i es van resoldre en un termini de pocs dies després de la vacunació. Una edat més gran es va associar a una freqüència lleugerament menor d’esdeveniments de reactogenicitat.
Vacunes de vectors virals:
Vacuna d’Oxford / AstraZeneca (ChAdOx1) (7)
Autorització per l’E.M.A: El 29 de gener del 2021. Tercera vacuna comercialitzada.
Característiques: És una vacuna formada per virus atenuats, en concret l’adenovirus del Chimpancé no replicatiu que vehiculen la proteïna S.
Com s’administra: S’administren 2 dosis de 0,5ml (2,5 x 108 unitats infeccioses) via intramuscular separades en un interval de temps d’entre 4 i 12 setmanes (28 i 84 dies) després de la primera dosi.
Indicacions: Indicada en persones des dels 18 fins als 65 anys a Espanya.
Contraindicacions: Contraindicada en cas d’hipersensibilitat al principi actiu o a algun dels excipients inclosos i en persones de més de 65 anys.
Eficàcia: L’eficàcia és del 70,4% després de 7 dies després de l’administració de la segona dosi.
Es va avaluar l’eficàcia de la vacuna ChAdOx1 contra la COVID-19 en persones de 18 o més anys. Es van administrar 2 dosis a l’estudi del Regne Unit separades per 12 setmanes i a l’estudi del Brasil per 6 setmanes. S’ha conclòs que l’eficàcia de ChAdOx1 és del 70,4% després de dues dosis, amb una protecció primerenca del 64,1%. Després de com a mínim una dosi estàndard. No es van mostrar diferències significatives quant a les estimacions d’eficàcia respecte al període entre dosis de la vacuna.
Seguretat: La vacuna presenta un perfil de seguretat acceptable.
Reaccions adverses: Les reaccions adverses més freqüents són sensibilitat al lloc de la injecció (63,7%), dolor al lloc de la injecció (54,2%), cefalea (52,6%), fatiga (53,1%) ), miàlgia (44%); malestar (44,2%), febre i calfreds (31,9%), artràlgies (26,4%) i nàusees (21,9%). La majoria són lleus o moderades, després de la segona dosi de vacuna són més suaus i tenen menys freqüència. Pel que fa als casos notificats de trombosi i trombocitopènia, de vegades acompanyats d’hemorràgia, han estat molt poc freqüents i el balanç risc – benefici continua superant el risc de possibles reaccions adverses.
Vacuna de Jansen/ J&J (Ad26.COV2-S) (8) (9)
Autorització per l’E.M.A: L’11 de març del 2021. Quarta vacuna autoritzada.
Característiques: La vacuna Ad26.COV2.S és un vector d’adenovirus humà de serotip 26 (Ad26) de replicació incompetent recombinant, que conté material genètic al seu interior per codificar la proteïna S del SARS-CoV-2.
Com s’administra: S’administren 1 dosi que conté 5 x 10^10 partícules virals via intramuscular com a dosi única.
Indicacions: Indicada en persones de 18 anys o més.
Contraindicacions: Contraindicada en cas d’hipersensibilitat al principi actiu o a algun dels excipients inclosos.
Eficàcia: La vacuna de Janssen va tenir una eficàcia general del 66% en la prevenció de la COVID-19 de moderat a greu, als 28 dies després de la vacunació. L’inici de la protecció ja es va observar el dia 14. El nivell de protecció contra la infecció per COVID-19 de moderada a greu va ser del 72% a l’estudi realitzat als Estats Units, del 66% a Amèrica Llatina i del 57% a Sud-àfrica, 28 dies després de la vacunació.
Seguretat: La vacuna presenta un perfil de seguretat acceptable.
Reaccions adverses: Els efectes adversos més freqüents van ser generalment d’intensitat lleu o moderada i els resultats van millorar al cap d’un o dos dies després de la vacunació. Els efectes adversos més habituals, presents en més de 1 de 10 persones, són dolor al lloc de la injecció, cefalea, astènia, miàlgies i nàusees.
Vacunes contra el SARS-CoV-2:
A continuació, s’analitzen algunes de les principals vacunes que s’estan desenvolupant a tot el món, algunes ja aprovades, davant del SARS-CoV-2. Veure Taula 1. (10)
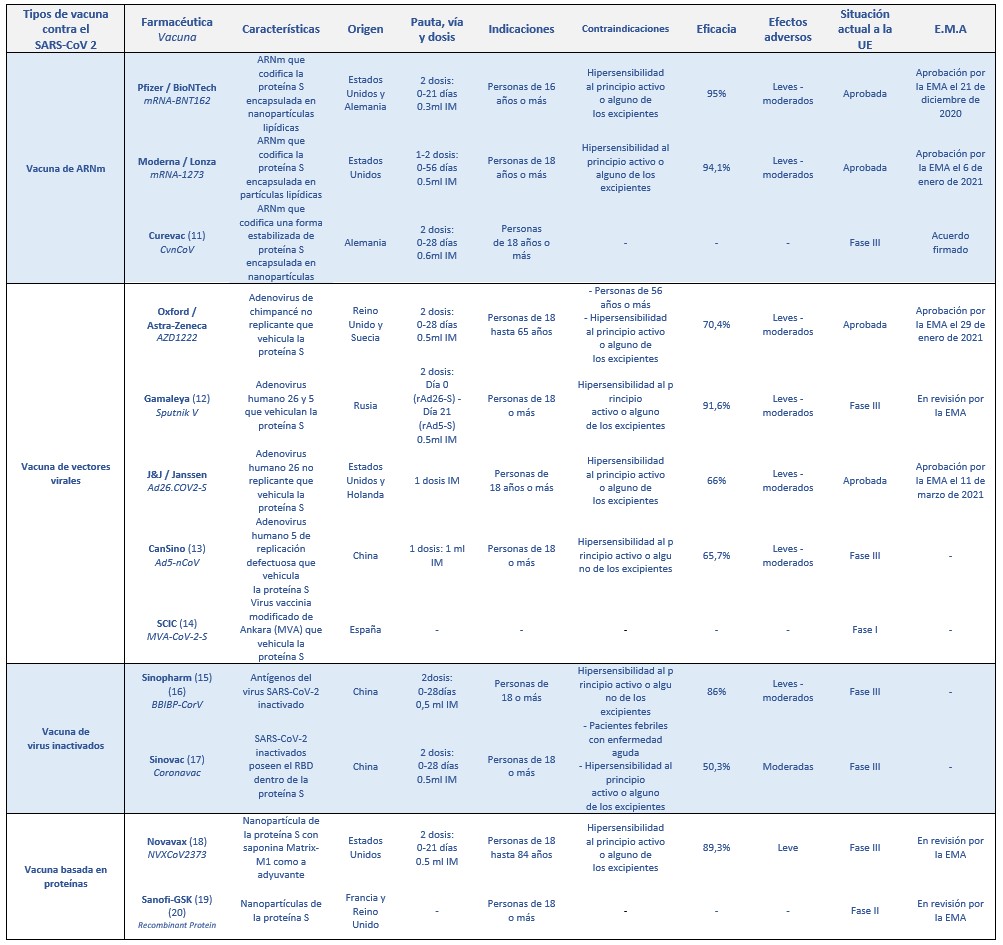
Taula 1: Vacunes contra el SARS-CoV-2
Conclusions
La situació de pandèmia actual, la pitjor en els darrers 100 anys, ha propiciat la major inversió en investigació i desenvolupament de vacunes sobre una malaltia mai vista, actualment hi ha més de 300 vacunes en desenvolupament a tot el món, que estem segurs que aconseguiran reduir, de manera dràstica, les conseqüències devastadores d’aquesta malaltia, sempre amb les garanties d’eficàcia, seguretat i farmacovigilància de les agències reguladores. Per això reclamem que es prioritzi la salut de tots els ciutadans del món per igual i per sobre dels interessos econòmics i polítics, que per desgràcia estem vivint en el context del desenvolupament i distribució de les vacunes. Els autors d’aquest article ens adherim a la Declaració de l´Equitat Vacunal de l´O.M.S. i recolzem la iniciativa COVAX per reduir les desigualtats en la vacunació a tot el món.
Font: Departament de Salut
Bibliografia
- Belete TM. Review on Up-to-Date Status of Candidate Vaccines for COVID-19 Disease. Infection and Drug Resistance. 2021; Volume 14: p. 151-161.
- Vacunas en desarrollo frente a la COVID-19. «State of the art». SEFAP. 2020.
- Ministerio de Sanidad, Consumo y Bienestar Social – Profesionales – Salud pública – Prevención de la salud – Vacunaciones – Programa vacunación – Vacunas COVID-19. MCSBS. 2021.
- Comisión Europea. Autorización de vacuna Covid-19. Preguntas y respuestas sobre la vacunación contra la COVID-19 en la UE. 2021.
- Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. PubMed Central (PMC). 2020.
- Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. PubMed Central. 2020.
- Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. PubMedCentral (PMC). 2021.
- Interim Results of a Phase 1–2a Trial of Ad26.COV2.S Covid-19 Vaccine. PubMed. 2021.
- A Study of Ad26.COV2.S for the Prevention of SARS-CoV-2-Mediated COVID-19 in Adult Participants. Clinical Trials. 2020.
- Lead SARS-CoV-2 Candidate Vaccines: Expectations from Phase III Trials and Recommendations Post-Vaccine Approval. PubMed Central (PMC). 2021.
- CVnCoV – CureVac’s mRNA-based vaccine candidate against COVID-19. CureVac. 2021.
- Logunov, D. Y., & Gintsburg, A. L. (2021). Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. The Lancet. ; 397(10275): p. 671-681.
- Phase III Trial of A COVID-19 Vaccine of Adenovirus Vector in Adults 18 Years Old and Above. ClinicalTrials. 2020.
- La vacuna del CSIC más adelantada para la covid-19 muestra una eficacia del 100% en ratones. Cnb, C. 2021.
- A Study to Evaluate The Efficacy, Safety and Immunogenicity of Inactivated SARS-CoV-2 Vaccines (Vero Cell) in Healthy Population Aged 18 Years Old and Above. Clinical Trials. 2020.
- Vacuna SINOPHARM. Ministerio de Salud de Argentina. 2021.
- FICHA VACUNA CONTRA SARS-COV-2. VACUNA CORONAVAC LABORATORIO SINOVAC LIFE SCIENCE®. 2021.
- Novavax COVID-19 Vaccine Demonstrates 89.3% Efficacy in UK Phase 3 Trial. Novavax Inc. – IR Site. 2020.
- Study of Recombinant Protein Vaccine With Adjuvant Against COVID-19 in Adults 18 Years of Age and Older. Clinical Trials. 2020.
- Two Vaccine Candidates against COVID-19. Sanofi. 2020.
Citació
Autors: Garcia Torres, Marta; Planchuelo Calatayud, Daniel
Títol: Anàlisi de les vacunes contra la COVID-19
Revista: APSalut. Volum 9. Número 2. Article 175
Data: 19 d’abril de 2021

